|
Hyménoptères porte-aiguillon et leurs glandes venimeuses
ASPECTS HISTOLOGIQUES DES GLANDES VENIMEUSES CHEZ LES
HYMENOPTERES ACULEATES
(IMAGOS)
|
Couleurs
conventionnelles :
En bleu clair, termes
anatomiques ; en violet,,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ;en bleu fonce, groupements d'un rang plus élevé ; en orange,, parties
les plus importantes
et résumés; en bleu et souligné, liens divers.
|
Cette thèse a été rédigée au début des années 60 pour être soutenue en Juin 1966 (Université des Sciences de Montpellier) alors qu’à partir de 1936 (recherches d’ Espérandieu et de Schlusche), la littérature zoologique ne comportait plus que de rares travaux claisemés. Ces publications étaient fragmentaires, limitées à des points de détail ou à des groupes zoologiques restreints : Fourmis (Forbes,1938 ; Whelden,1956 ; Callahan& al., 1959,1963),Vespidae (Toledo-Piza & al.,1946 ; Crouch & Smith,1957), Apidae (Bonhomme,1948).
Dans la plupart des travaux sus-mentionnés, l’histologie des glandes venimeuses passe au second plan. D’autre part, certaines super-familles dont les représentants ne sont pas vulnérants pour l’homme ou ne le piquent qu’occasionnellement, ont été sacrifiées au profit des Vespidae, Apidae et Formicidae. C’est notamment le cas des Pompiloidea et des Scolioidea.
Ainsi, je n’ai relevé aucun travail histologique concernant les Pompiles. Ces derniers n’avaient du reste été dégagés que tout récemment des Vespoidea (Berland,1947) auxquels on les assimilait jusqu’alors.
Par ailleurs, les Scolioidea n’avaient fait l’objet d’aucune étude morphologique interne hormis celle de Pawlowsky (1914) chez Scolia villosa et Mutilla maura, recherches ne décrivant que la seule anatomie macroscopique des glandes à venin.
La nécessité d’une vaste étude histologique d’ensemble telle que A.Lopez l'a présentée en 1966, était donc pleinement justifiée par les diverses lacunes, imprécisions, voire même les contradictions relevées et surtout, par l’absence, jusqu’alors, d’un travail « panoramique » analogue.
L'auteur déplore seulement de ne pas avoir pu disposer pour les Hyménoptères du microscope électronique (MEB et surtout MET), le privant ainsi de l’apport ultrastructural auquel nul autre chercheur n’avait encore fait appel et qui lui aurait alors apporté un avantage indéniable, comme beaucoup plus tard en Anatomie des Araignées.
1- Généralités
L’ordre des Insectes Hyménoptères (Linné 1758), l’un
des plus riches du règne animal, se divise en Symphytes et en Apocrites
ou Pétiolés.
Ces derniers sont eux-mêmes subdivisés en Térébrants ou
Porte-tarières et en Aculéates ou Porte-aiguillons.
Les Hyménoptères
Aculéates sont, à bien des égards,
les plus remarquables des Insectes de leur ordre.
Ils se
répartissent en 7 superfamilles.
2- Anatomie de l’appareil
venimeux
L’appareil
venimeux n’existe que chez les
femelles.
2-1- Constitution
d’ensemble
Il se compose d’un dispositif
inoculateur inconstant, l’aiguillon, formé lui même par le gorgeret et
deux dards, et d’un complexe
glandulaire.
Le gorgeret présente une base bulbeuse ou ampullaire
formant
la chambre à
venin et une face antérieure excavée
en gouttière longitudinale.
Cette gouttière est bordée par deux saillies en
forme de «rails».
Chaque dard présente une coulisse emboitant un
« rail » du gorgeret, de sorte qu’un canal résulte de
leur affrontement.
Le complexe
glandulaire est intra-abdominal et
généralement décrit comme
constitué par deux glandes : la glande
acide
ou
mulifide et la glande alcaline, encore appelée
glande de Dufour ou glande
sébifique.
La glande
acide, ainsi nommée car, à
l’état frais, elle rougit le papier au tournesol, est en position
dorsale et comprend trois parties :des tubules glandulaires sécrétants,un réservoir
ou
vessie à venin et un canal excréteur
ou canal
de décharge se terminant dans l’aiguillon. Pour certains auteurs, elle serait seule
productrice
du venin.
La glande
alcaline présente une réaction
basique, est en position ventrale dans le plan de symétrie de l’Hyménoptère,
au
contact du canal excréteur de la glande
acide, a l’aspect d’un tube bosselé
sans réservoir individualisé et s’entoure
d’un sphincter dans sa
partie inférieure. Son point de terminaison a été très
discuté (canal
de la glande acide, cavité vaginale) ainsi d’ailleurs que son rôle
(diminution de l’acidité du venin, lubrification des dards,
agglutination des œufs…).
2.2-Variations anatomiques
Elles sont très
nombreuses, celles des divers segments de la glande
acide permettant de reconnître 3
grands
types morphologiques :
►le type vespide (Vespoidea,
Pompiloidea) à tubes acides simples et débouchant isolément dans une vessie ovoïde
très musclée, non déformable, renfermant la glande médiocystique (Espérandieu,1936) (Fig.1).
►le type apide (Apoidea, Sphecoidea,
certains Scolioidea -Scoliidae, Mutillidae-, un grand nombre de Formicoidea
et les Bethyloidea Chrysidae) à
tubes
acides ramifiés puis unis en tronc
commun débouchant dans une vessie ovoïdo-conique peu musclée, déformable, sans
glande médio-cystique (Fig.1).
►le type mixte, non isolé par Pawlowsky (1914),
incluant certains Scolioidea (Sapygidae), Formicoidea
(Poneridae),
dont la vessie à venin évoque celle du type vespide (forte musculature, glande médiocystique) mais dont tous
les autres caractères se
rapportent au type apide.
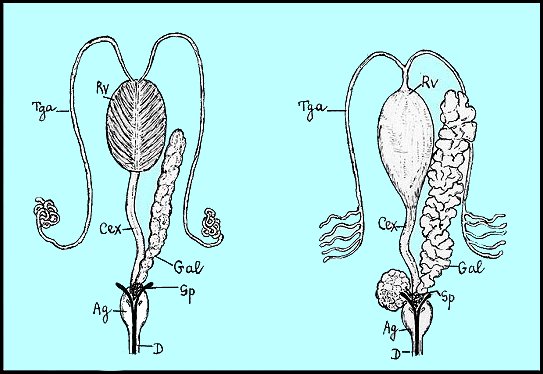 |
| Fig.1.- Les deux
types d'appareils venimeux : type Apide, à droite, et Vespide, à gauche
|
| Ag, ampoule du
gorgeret ; Cex, canal excréteur acide ; D, dard ; Gal, glande alcaline
; Rv, réservoir (vessie) à venin ; Sp, sphincter ; Tga, tube
glandulaire acide (Dessins originaux A.Lopez). |
A côté de ces deux glandes
classiques, il peut exister, comme chez certains Térébrants, un troisième organe dit glande accessoire s’ouvrant au pourtour du gorgeret
(Fig.2).
Elle est paire chez les Apoïdes
(glande de Koschevnikov) et impaire
chez les Sphecoidea (Crabronidae et Philanthus : glande de
Bordas)
3 -Apports des travaux
histologiques personnels en 1966
Les femelles des Hyménoptères
Aculéates possédent un appareil
venimeux annexé au tractus génital ; il se compose typiquement
d’une glande acide et d’une glande
alcaline ou glande de Dufour
La première est constante.
La seconde semble manquer chez les Chrysidae (Bethyloidea)
et
au moins dans le genre Ammophila
chez les Sphecoidea.
Il existe fréquemment une glande accessoire
qui se rencontre en fait chez la plupart des Sphecoidea, chez les
Scolioidea où son développement peut être considérable (Scoliidae), et même dans la super-famille des Formicoidea.
Les glandes acide
et alcaline sont entièrement indépendantes l’une
de l’autre, non seulement chez Apis mellifica (Trojan,1930) mais aussi chez tous les Aculéates, l’acide s’ouvrant dans la base du gorgeret et l’alcaline
s’abouchant à la partie toute supérieure du canal des dards
après s’être entourée
d’un sphincter à fibres
musculaires radiées.
3.1.- Glandes accessoires
Décrites pour
la première fois par Bordas (1894 à 1897) chez les Térébrants et quelques Sphecoidea,
elles sont formées par un ensemble de glandules
pauci-cellulaires indépendantes
allant déboucher dans un cul de sac
collecteur commun par leurs canaux excréteurs individuels.
3.1.1.- Scoliidae
(Scolioidea).
Une glande accessoire impaire
remarquable est
présente chez les Scoliidae
où elle ne semble pas avoir été signalée jusqu’en 1966.
Celle de Campsomeris
(Elis,
Colpa) sexmaculata F. (Figs.2,3) étant
particulièrement bien développée, l'auteur l'a
choisie comme type de description (Fig.3).
 |
 |
| Fig.2 -
Campsomeris
(Elis,Colpa) sexmaculata, mâle (© A.Lopez) |
Fig.3 -
Campsomeris
(Elis,Colpa) sexmaculata, femelle
(© A.Lopez) |
 |
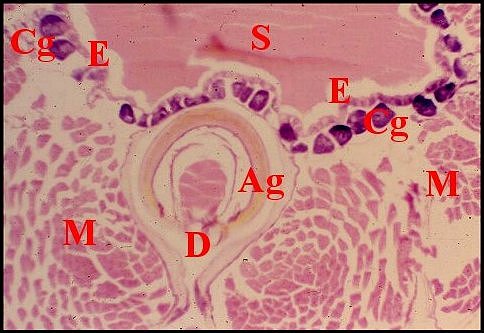
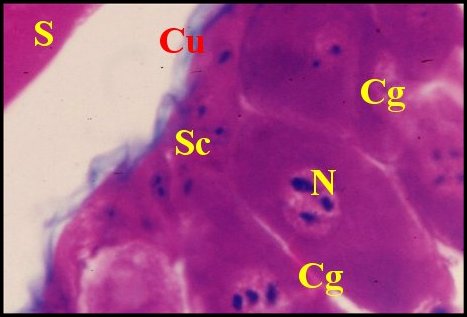
| Fig.4 - Campsomeris sexmaculata : glande accessoire en coupe transversale |
| G, glande ; M, muscle ; S, sécrétion ; T, gorgeret (© A.Lopez) |
Offrant l’aspect d’une vaste poche brunâtre translucide (près d’1 mm de large), elle occupe tout l’espace laissé libre, au niveau des 2 derniers tergites abdominaux, par les masses musculaires, le rectum, et remonte jusqu’à mi-hauteur du réservoir à venin.
Elle réalise fréquemment dans les coupes transversales une curieuse figure en «T» avec une portion antérieure sagittale allant à la rencontre du gorgeret, et une portion postérieure frontale qui est perpendiculaire à la précédente (Fig. ).
Le canal excréteur de la glande acide est accolé à sa paroi mais ne la refoule pas..
La cavité
glandulaire est spacieuse, largement béante, en
nette continuité avec la gaine membraneuse
qui circonscrit le gorgeret
et renferme une substance
sécrétoire très abondante, finement grenue, PAS +, se colorant
fortement par l’orange G alors
que le contenu du tractus acide capte plutôt l’éosine.
La paroi glandulaire est formée
par une intima et par deux assises de cellules (Fig.
).
L’intima est un revêtement cuticulaire épais de quelques
µm, sinueux, colorable par le vert lumière, le bleu d’aniline et le
bleu diamine 2 B.
L’assise
cellulaire interne ou sous-cuticulaire
(sous-intimale) est un épithélium
simple formé par des cellules régulières,
prismatiques (hauteur moyenne : 15 µm), à cytoplasme peu
colorable, PAS -, pyroninophobe et à noyau arrondi, ponctué de blocs chromatiniens (Fig. ). Il est possible que
leurs pôles apicaux soient garnis de microvillosités, que le cytoplasme renferme du réticulum endoplasmique lisse et que les cellules
épithéliales soient en fait des
adénocytes appartenant à la classe 1 que Noirot et
Quennedey
(1974) devaient définir, 6 ans plus tard, pour d’autres glandes d’ Insectes.
(sous
réserve...).
 |
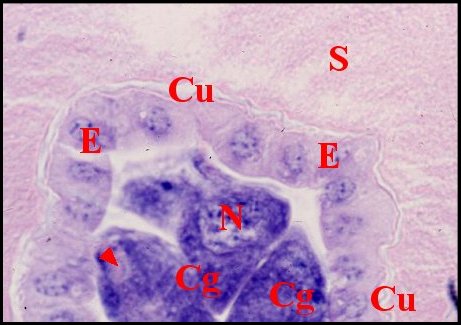 |
| Fig.5 - Campsomeris sexmaculata : vue
partielle de la glande |
Fig.6 - Campsomeris sexmaculata : détail de la
paroi |
|
Ag, ampoule du
gorgeret ; Cg, cellules glandulaires de l'assise externe ;
Cu, cuticule intimale ; D, dards ; E, assise interne épithéliale
; M, muscles ; N noyau adénocytaire ; S, sécrétion
(© A.Lopez, coupes histologiques)
|
L’assise externe est
discontinue. Elle est formée par
de grosses cellules rarement jointives mais non disposées en un
véritable épithélium, plus larges que hautes (40 µm/ 20 µm) et
paraissant offrir 3 à 6 faces latérales (Fig. ).
Leur pôle
basal est parfois déprimé par les trachéoles,
les
muscles et les nerfs voisins.
Leur pôle
apical , adhérant à l’assise sous-cuticulaire, est aplati ou
étiré en tronc de cône.
Le noyau est volumineux, plurinucléolé et polymorphe,
souvent incurvé..
Le cytoplasme est PAS – mais remarquable par son intense
basophilie que supprime la ribonucléase. Il est également très
pyroninophile,
ce qui témoigne aussi de sa richesse en ARN, donc de la présence
vraisemblable d’un réticulum
endoplasmique granulaire développé.
Une plage
acidophile arrondie, colorable par
l’orange g, est visible au-dessus du noyau
qui peut la recevoir dans une
concavité (Fig. ). Ce réservoir
correspond à la cavité
extracellulaire et contient
peut-être un appareil terminal (end
apparatus). Il s’en détache un canalicule excréteur large de 3 à 4 µm, rectiligne, coudé à angle
droit ou incurvé en arc, contenant aussi une substance orangéophile qui
le met bien en évidence, et sortant de l’adénocyte par
une face ou par son apex étiré. Ce conduit s’insinue ensuite entre 2 ou 3 cellules sous-cuticulaires (à moins qu’une seule d’entre elles ne les
enveloppe), franchit l’intima et s’ouvre enfin dans la cavité glandulaire commune pour y déverser la sécrétion.
La Canal excréteur est court
(moins de 100 µm), large, se détache de la partie la plus antérieure de
la glande et s’ouvre au pourtour du gorgeret. Caractérisée par la disparition des gros adénocytes (assise externe),
sa paroi n’est plus formée que par l’intima et par
les cellules sous-cuticulaires qui s’aplatissent progressivement……..
Il semble exister une troisième catégorie de
cellules, peu visibles, près des pôles apicaux et au contact de
l’assise interne et des canalicules excrteurs…..
Chez Campsomeris villosa, Megascolia
(Scolia)
maculata flavifrons(Fig. ), S. hirta et S.quadripunctata, les cellules
de l’assise externe sont identiques
à celles d’ Elis
sexmaculata. En revanche, l’intima est
nettement plus mince, pouvant ne former qu’un liseré à peine
perceptible (Fig.6,7) ; de même, l’épithélium
sous-cuticulaire est moitié moins
haut chez Campsomeris
villosa, Scolia
flavifrons et va jusqu’à se
réduire à quelques cellules plates et clairsemées chez les deux autres
espèces.
 |
 |
| Fig.7 - Megascolia maculata flavifrons, femelle
(© A.Lopez) |
Fig.8 - Megascolia
maculata flavifrons,
femelle (© A.Lopez) |
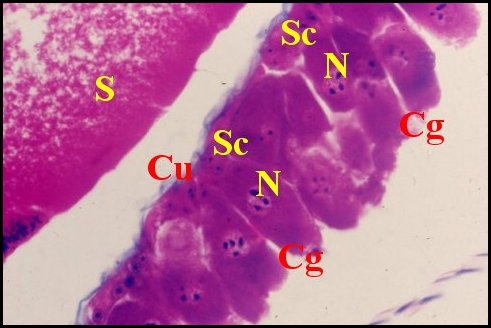 |
 |
| Fig.9- Scolia flavifrons : paroi
de la glande accessoire, vue trés partielle
|
Fig.10 -
Détail de cette paroi |
| Cg,
cellules glandulaires externes ; Cu, cuticule intimale ; N, noyau de
cellule glandulaire ; S, sécrétion (© A.Lopez, coupes histologiques) |
|
Ainsi décrite, la
glande accessoire
des Scoliidae entre dans le cadre des glandes tégumentaires
anatomiquement définies au sens
de Noirot et Quennedey (1974,1991) et vraisemblablement
constituée d’unités fonctionnelles identiques juxtaposées dont l’adénocyte se
rattache à la classe 3 telle que
ces
deux auteurs l’ont conçue pour d’autres organes d’ Insectes.
Il est possible
que l’épithélium interne ait
lui
aussi une valeur glandulaire, ses cellules se rattachant alors à la
classe 1.
3.1.2.- Sphecidae
http://faune-flore-languedocienne.alwaysdata.net/garrigue/Insectes_Hymenopteres_Sphecidae.html
Dans une série de travaux
présentés de 1894 à 1897, Bordas a décrit la glande accessoire qui porte son nom chez les Ichneumon mais aussi
chez certains Sphégiens (Crabro,
Philanthus).
Il l’a décrite comme une petite masse granuleuse et blanchâtre
située au-dessous du rectum, offrant
un aspect histologique rappelant la glande
acide.et reliée au gorgeret par
un
canal filiforme s’accolant à celui de la glande alcaline.
En fait, une dissection fine des viscères abdominaux a
permis à l'auteur de constater que le
canal excréteur est une
dépendance du manchon protecteur de l’aiguillon, va
s’ouvrir au pourtour du gorgeret et non dans l’ampoule de sa chambreà
venin, particularité que
confirment fort bien les coupes sériées.
Ces dernières montrent par ailleurs que la glande de Bordas
s’apparente histologiquement à la volumineuse glande annexe
des Scoliidae
et à l’organe de Koschevnikov.
Elle est formée
par des glandules pauci-cellulaires annexées à un canal
collecteur commun, agminées sans
ordre apparent et ne formant donc pas un pseudo-épithélium comme chez les Scoliidae
(Fig.8 et 9).
Chaque glandule se compose d’une cellule
sécrétrice ou adénocyte, d’un canalicule excréteur et d’une cellule canalaire.
L’adénocyte,
globuleux ou de forme polyédrique, renferme un gros
noyau à nucléole trés apparent et
une aire cytoplasmique en "réservoir"
arrondi pouvant correspondre à une cavité
extra-cellulaire sur le plan
ultrastructural. Le canalicule excréteur
y débute par une portion arquée,
vraisemblablement
"réceptrice", logée, du moins en partie,
dans
le "réservoir" et que met bien en évidence
la
méthode de Bodian (Fig.9). Il se poursuit par une portion "conductrice" plus ou moins longue, grêle,
flanquée d'une cellule canaliculaire
qu'individualise un petit noyau allongé,
d'aspect "ponctué" (Fig.8).
Toutes les portions
conductrices aboutissent au canal
collecteur commun ralliant le gorgeret.
 |
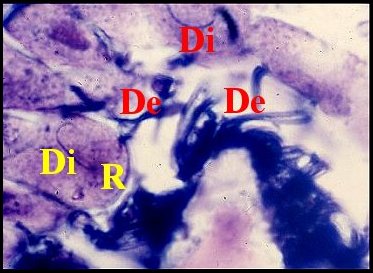 |
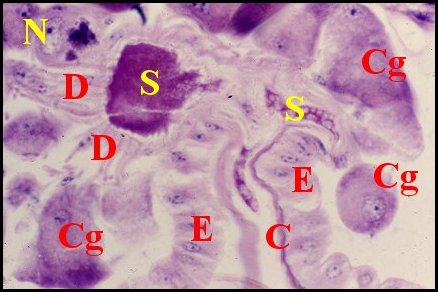
| Fig.8
- Ammophila hirsuta : glande accessoire et son canal collecteur |
Fig.9-
Détail, méthode de Bodian |
| C,
cuticule du canal collecteur commun ; D, canalicule excréteur (portion
conductrice) ; E, épithélium du canal ; N, noyau ; S, sécrétion |
De,
portion extra-cellulaire (conductrice) du canalicule ; Di, portion
réceptrice ; R, réservoir. |
Ce dernier a l'aspect d'un cul
de sac formé par une intima chitineuse et
un épithélium erxterne. Il comporte en
fait deux parties : proximale
ou profonde, aplatie dorso-ventralement, et distale, comprimée latéralement. Dans la
première, l'épithélium se réduit à des cellules aplaties, dont le
noyau
est seul bien visible ; sa cuticule
est en revanche
trés
épaisse. Dans la distale, l'
épithélium est acidophile, prismatique haut et revêtu par une cuticule intimale trés mince (Fig.8).
La présence de
cette glande accessoire
ne se réduit pas aux Crabronidae et Philanthidae
(Bordas) mais
au contraire est un
caractère général chez les Sphecidae.
Elle entre aussi dans le cadre des glandes tégumentaires
anatomiquement définies
et est
vraisemblablement constituée d’unités fonctionnelles identiques dont
l’adénocyte se
rattache à la classe 3 de Noirot
et
Quenbnedey (1974).
La glande
accessoire semble atteindre son
maximum de développement chez les Pemphredonidae, chasseurs d’Homoptères.
C’est ainsi que
dans le cas de Mimesa
unicolor, elle se présente comme une vaste poche interposée
entre le rectum et l’aiguillon, renfermant de la sécrétion et rappelant, à
première vue celle des Scoliidae (Fig.10). Sa paroi n’est toutefois
constituée que par une assise unique de cellules glandulaires reposant sur une basale. Ces adénocytes sont très basophiles, avec une
petite zone sous-apicale captant l'éosine, ne sont pas séparés de la cavité glandulaire par une cuticule et
semblent y déverser directement leur sécrétion, aucun canalicule excréteur n'ayant pu être mis en
évidence. Il se pourrait qu'une telle absence d'appareil cuticulaire ne
soit qu'un artéfact de préparation.
 |
| Fig.10- Mimesa unicolor : coupe transversale de
l'abdomen montrant la glande accessoire,
et détail. |
|
A, adénocytes ; D, dards ; G,
gorgeret ; M, muscles ; R, rectum ; S, sécrétion ; T, tube cardiaque.
(Dessins originaux A.Lopez). |
3.2- Glandes médiocystiques
Encore appelées intracystiques, elles doivent ces
qualificatifs à leur localisation particulière : en pleine cavité de la vessie
ou réservoir à venin.
3.2.1-
Vespoidea
L’appareil venimeux est constitué par une glande acide
et
une glande alcaline. Il est dépourvu de glande accessoire (Fig. ).
Réservoir à venin.
La glande
acide comporte un réservoir à venin se présentant comme
une masse ovoïde, plus ou moins tronquée, blanc-jaunâtre ou orangée,
montrant 4 valves
lancéolées épaisses, striées obliquement et que séparent autant de sillons
longitudinaux.
La paroi
cystique est épaisse, cette
épaisseur, maximum au niveau des valves, liée à la musculeuse
et variant beaucoup d’une famille à l’autre. Elle se compose d’une
intima cuticulaire, de cellules
sous-intimales disséminées, peu
visibles, à noyau discoïde,
correspondant à un épithélium trés
aplati, non observées par Espérandieu, et surtout, de fibres musculaires
striées d’orientation très
régulière, s’insérant
sur la cuticule, formant la
quasi-totalité des
valves.
La cavité ou lumière cystique, grossièrement losangique ou cruciforme,
renferme un matériel sécrétoire
acidophile, PAS + et, fait particulier, une petite masse blanchâtre et
bilobée qu’un
filament transparent rattache à la paroi : la glande médiocystique découverte et décrite par Espérandieu (1936)
chez Vespa
crabro mais passée jusqu’ici
sous silence la littérature spécialisée !
 |
| Fig. 11 - Vespa
crabro : Réservoir à venin (moitié de l'organe) et glande
médiocystique |
| E, intima et cellules sous-intimales ;
Gm, glande médiocystique ; L, lumière ;
M, musculeuse ; S, sécrétion. |
J’ai
rencontré ce curieux organe
chez tous les Vespoïdes
étudiés, Masaridae
compris (Fig.10). Une structure analogue se retrouve d’ailleurs
dans la super-famille des Pompiloidea (confere infra).
Sa structure histologique est des plus
uniformes.
Dans tous les cas, la glande d’Espérandieu se présente commeune invagination intra-cystique
des tubes acides.
Elle comporte un
conduit chitineux en
«pédicelle», faisant suite aux deux précédantscorrespondant au
« filament » sus-mentionné tubulaire,
et une masse glandulaire….
3.2.2-
Pompiloidea…..
3.2.3- Formicoidea
Rattaché au type Vespide
par Pawlowsky (1914), l’appareil venimeux des Formicoidea est constitué
par une glande acide, une glande
alcaline et comporte parfois une
glande accessoire.
Il peut exister
aussi une glande médiocystique. Je l’ai découverte chez Paraponera clavata (Guyane française) de la famille des Poneridae,
Fourmis inférieures abondant sous les
Tropiques
et dont la piqûre est très redoutée.
Réservoir à venin.
La glande
acide comporte un réservoir ou vessie
à venin se
présentant comme une
masse allongée selon le grand axe abdominal et de forme ovoïde. Son
diamètre peut atteindre 3 mm.
Sa cavité renferme toujours un matériel sécrétoire acidophile, granuleux ou homogène et d’aspect
craquelé.
Chez Paraponera, la paroi cystique est trés
mince dans son ensemble,
réduite à une simple membrane
chitineuse sans noyaux visibles. Cette membrane
se plisse en «accordéon» au niveau de
l’abouchement du canal commun
terminal et s' entoure de fibres musculaires striées y épaississant
aussi le réservoir
trés localement
(Fig. 12)
 |
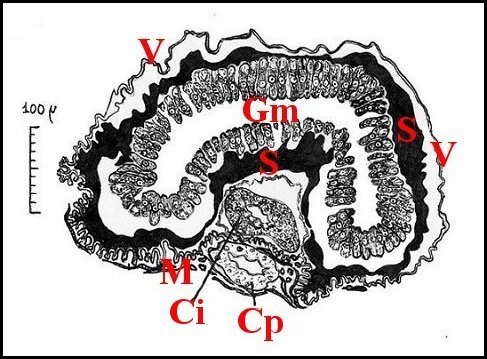 |
| Fig.12
- Paraponera clavata : Canal
commun acide dans la paroi cystique |
Fig.13
- Paraponera clavata :
vessie et glande médiocystique,
coupe transversale |
| Cp,
canal commun intra-pariétal ; Ci, même canal pénétrant dans la cavité
du réservoir pour s'y "retrousser" en glande
médio-cystique (Gm) ; M, muscles
striés ; S, sécrétion ; V, membrane chitineuse vésiculaire,
plissée dans la Fig.12 (Dessins originaux A.Lopez) |
|
). |
|
Chez
Paraponera,
le canal
commun se libère de la paroi, pénètre
dans la cavité du réservoir et s’y « retrousse », en une lame
cellulaire évoquant la glande
médiocystique des Vespoidea et
des Pompiloidea. Elle se présente dans les coupes
transversales comme une sorte de couronne déprimée en
« gastrula » (Fig.13).
Sa paroi est une juxtaposition de cellules glandulaires dont les pôles
apicaux sont recouverts par une membrane
chitineuse très mince, peu colorable et difficilement perceptible (Fig.
14). Chacun de ces adénocytes est de forme prismatique allongée (40 à 50 µm)
et renferme un noyau rond, très clair, nettement nucléolé
(Fig.14,15).
Le cytoplasme basal renferme des granulations
juxtanucléaires de taille variable,
ainsi que des inclusions
cristalloïdes losangiques ou en
batonnet, toutes colorées par l’hématoxyline phosphotungstique de
Mallory. Le cytoplasme
supra-nucléaire montre une plage
oxyphile ovalaire, en "dé à coudre"
s’orientant vers
le pôle apical. et correspondant à un
"réservoir", donc à une invagination membranaire (cavité
extracellulaire). Elle contient un canalicule axial court et rectiligne qui sort de l’adénocyte pour traverser immédiatement après la
membrane sus-jacente. Ce canalicule
est vraisemblablement récepteur en
quasi-totalité et ne semble pas s’accompagner d’une cellule canaliculaire.
 |
 |
| Fig.14
- Paraponera clavata : détails
de la glande médiocystique |
Fig.15
- Paraponera clavata : adénocytes
isolés |
| B,
pôle basal des adénocytes ; Cr,
inclusions cristalloïdes ; D, canal excréteur (de décharge) ; N, noyau
; R, "réservoir" ; S, sécrétion ; V,
paroi de la vessie. Flèches : membrane chitineuse
(Fig.14) et canalicule récepteur (Fig.15). (Dessins originaux A.Lopez) |
|
Les adénocytes ainsi
décrits apparaissent
progressivement dans la paroi du canal
commun avant qu'il ne pénètre dans la cavité
cystique ; elles en remplacent peu à peu les cellules claires et basses (Fig.16).
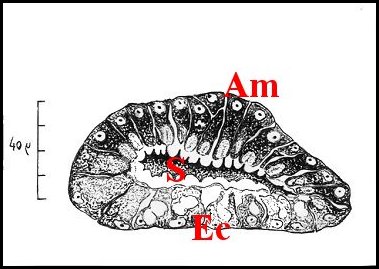 |
| Fig.16
- Paraponera clavata : canal
commun avant sa pénétration intra-cystique |
| Am, adénocytes
médio-cystiques ; Ee, épithélium
initial du canal commun ; S, sécrétion (Dessin
original A.Lopez) |
Commentaires sur les Scoliidae
(Lopez,2015)
Ce réservoir
correspond à la cavité
extracellulaire et contient
peut-être un appareil terminal (end
apparatus).
Bibliographie
Bordas,L.,1908 -Sur
quelques points d’anatomie des glandes venimeuses des Hyménoptères.Bulletin de la Société
entomologique de France Année 1908 13(8)
pp. 136-140
Chapman...1986Chapman, G. B., Barrows, E.
M.November, 1986Ultrastructural Features of the
Cells of Dufour's Gland and Associated Structures in the Carpenter Bee,
Xylocopa virginica virginica (L.) (Hymenoptera:
Anthophoridae)
Annals of the Entomological Society of America
Espérandieu,
L.M..,
1936.- Arch.Zool.exp.et gén., 78 (n°3), p.155-164.
Noirot,C. & A.
Quennedey.,1974.- Ann.Rev.Ent., 169, p.61-80.
Noirot,C. & A.
Quennedey., 1991.- Annls Soc.ent.Fr. (N.S.), 1991, 27 (2), p.123-128.
Pawlowsky,E.,1914.-
C.R.Soc.Biol.,LXXVI, p.351.
Trojan, E.,1930.-
Z.Morph.Oekol.Tiere, Berlin, 19, p.678-685.